Foxp3 - 制御性T細胞(Treg)の系譜決定転写因子か、機能的因子か?
一般に、Foxp3を発現するTregは、免疫細胞の活動を抑制するために特化したT細胞の別のタイプとされています。これは、すべてのTregが抑制性T細胞として機能している場合には正しい理論かもしれません。しかし現実は違います。実際には、どのTreg細胞が機能しているか、そしてどの細胞が機能していないかを特定することは困難です。さらに、とくにヒトにおいて、Foxp3を発現するT細胞の多くは機能的なTregではなく、むしろT細胞反応を引き起せる可能性が高いです。
重要なことに、Tregsが独自の細胞系列を構成するという、広く流布している概念は、坂口志文教授のグループから発表されたAsano et alらの研究成果に起因したものです。ところがAsano et alの核心的実験データが追試確認できないことが証明されています。 (Ono & Tanaka, 2016)。では、これからの研究で、我々はどのようにしてFoxp3とTregを解析・理解すればよいのでしょうか?
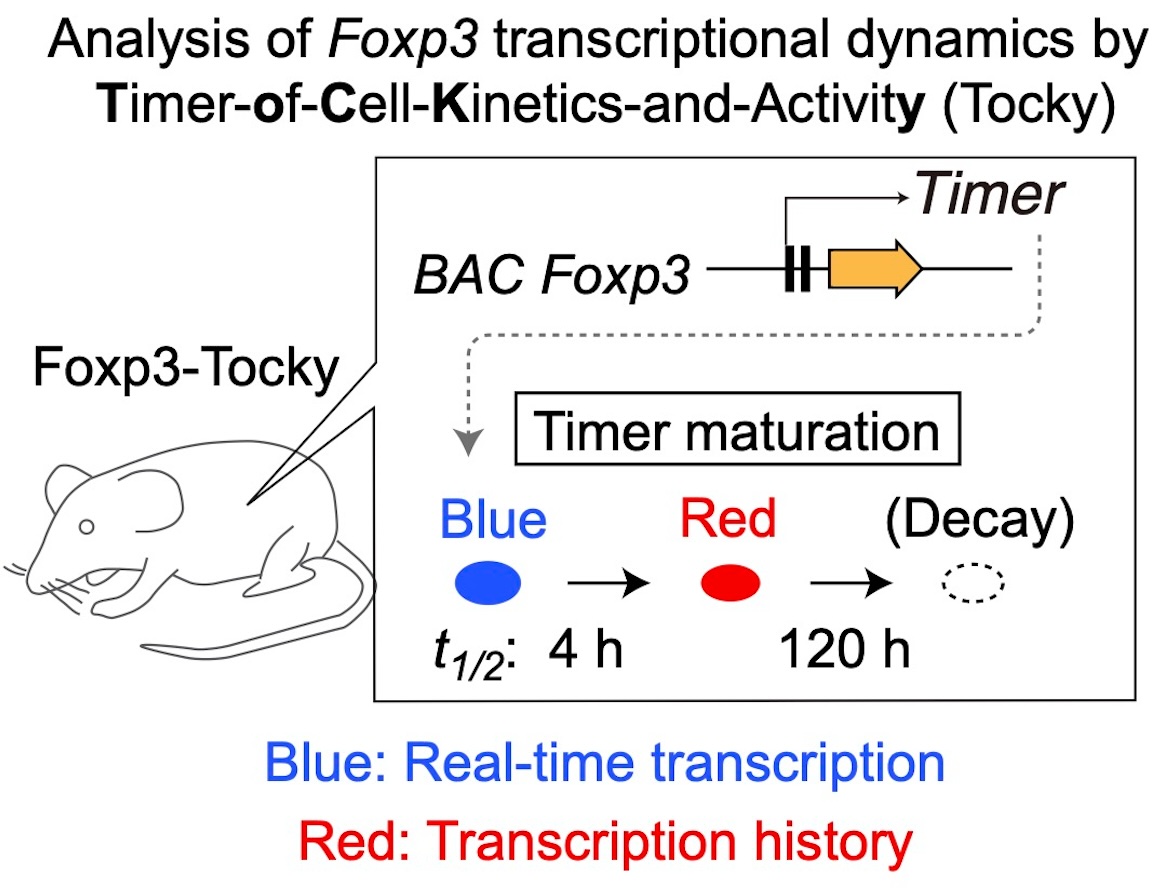
私たちのTocky論文第2弾(Bending et al., 2018)は、この問題に答えるために、時間動態解析を可能にしたTocky 技術を使い、Foxp3-Tocky – Foxp3転写の時間動態を解析するためのTockyマウス系統の有効性を確立しました。そして、定常状態(ホメオスタシス)・免疫反応中いずれの状態においても、Foxp3が抑制メカニズムのスイッチとして動的に誘導・調整されていることを発見しました。
Foxp3-Tockyの実験的検証
まず、Foxp3転写動態をよりよく理解するために、蛍光タイマー蛋白の半減期を実験的に決定しました。青色蛍光と赤色蛍光の半減期はそれぞれ4時間と120時間でした。これは、以前の報告がモデリングを通じて推定に依存していたのに対し、改善された測定です。
Tockyによって明らかにされたFoxp3転写ダイナミクスの免疫学的意義
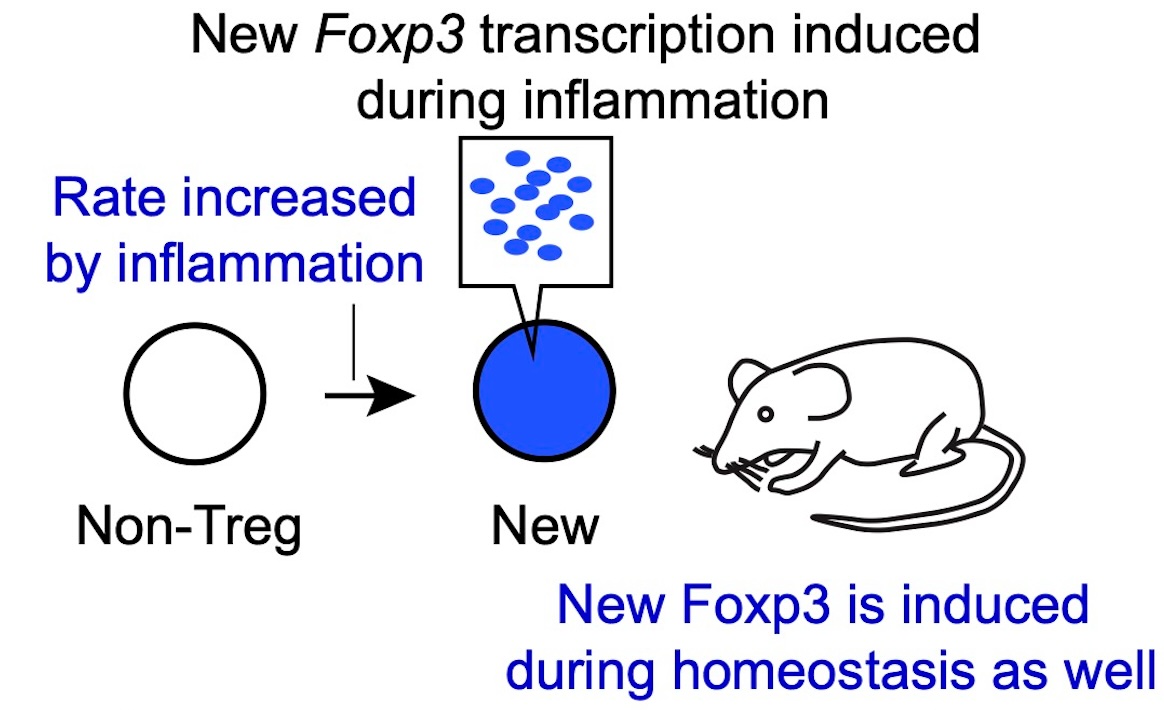
新たなFoxp3転写
ホメオスタシスと炎症状態を分析することにより、わずかながらも有意な割合のCD4+ T細胞でFoxp3の発現が新たに誘導され、これが自己免疫炎症中に増加することを示しました。これらの結果は、以前に想像されていたよりもFoxp3のより動的な調節を示しています。
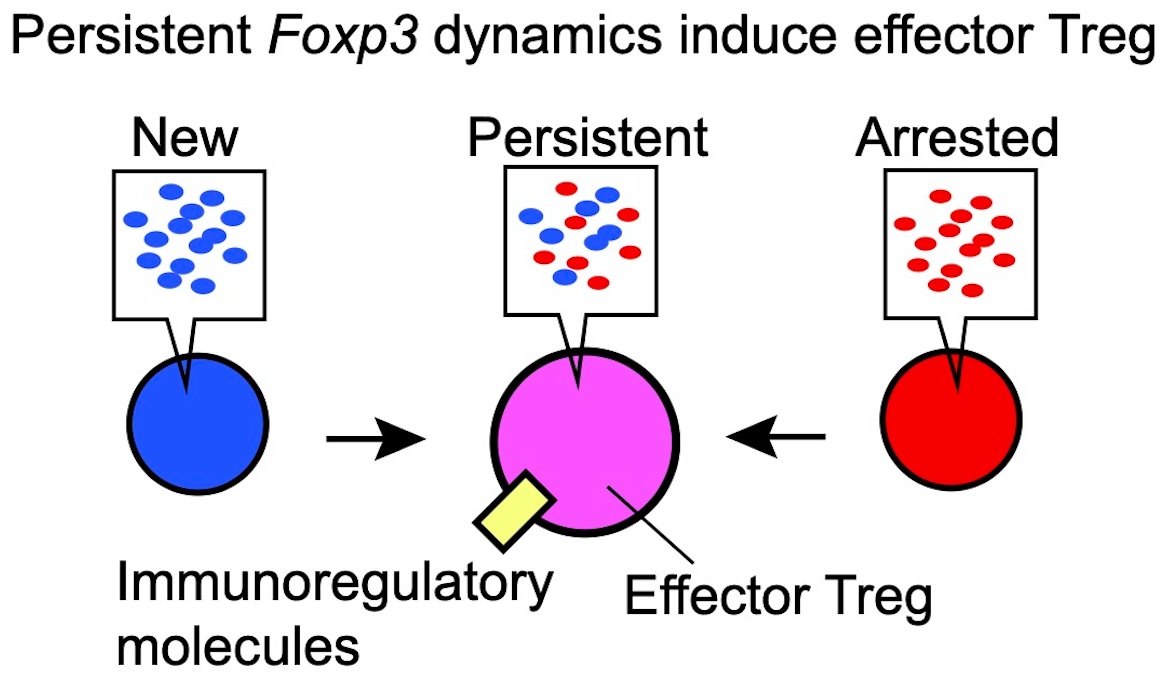
持続的なFoxp3転写
興味深いことに、持続的なFoxp3転写(Persistent transcription)は、免疫抑制機能が強まっているとされる、活性化Treg(effector Treg)の特徴であることが分かりました。
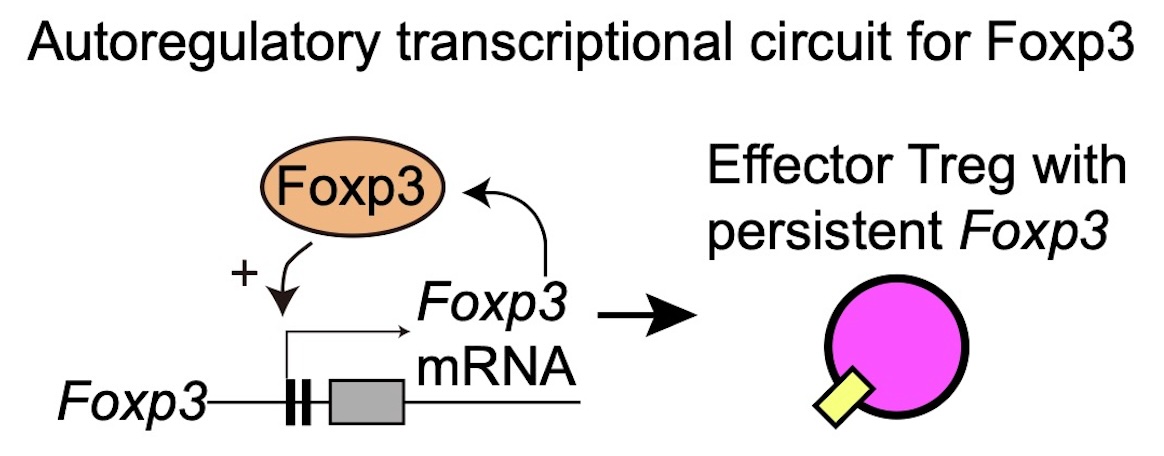
Tockyによって明らかにされたFoxp3の自己調節転写ループ
Foxp3-Tocky、Foxp3-EGFPノックイン、およびFoxp3低形成変異体(Foxp3 scurfy)を組み合わせたトリプルトランスジェニックマウスを作製することにより、機能的Foxp3蛋白の有無におけるFoxp3転写の調節を、これまでに前例のない方法で分析することができました。
このアプローチにより、Foxp3蛋白自体がFoxp3遺伝子の転写を増幅し、Foxp3の調節機能を強化する自己調節ループを形成しているという、重要な発見がなされました。
Tockyの免疫療法応用
Foxp3発現T細胞の時間動態の理解により、Foxp3動態を対象とした新しい免疫療法が可能になります。
本研究では、免疫療法抗体である抗OX40抗体を使用して、Foxp3を持続的に転写発現するT細胞(Persistent Foxp3 expressors)のアポトーシスを加速することによりこのような抑制機能をもったT細胞の数を激減させられることを示しました。
References
2018
-
A temporally dynamic Foxp3 autoregulatory transcriptional circuit controls the effector Treg programme
David Bending , Alina Paduraru , Catherine B Ducker , Paz Prieto Martı́n , Tessa Crompton , and Masahiro Ono
The EMBO journal, Sep 2018
The second Tocky paper from the Ono lab uncovers the temporally dynamic regulation of Foxp3 transcription, offering new insights into T cell regulation.
Regulatory T cells (Treg) are negative regulators of the immune response; however, it is poorly understood whether and how Foxp3 transcription is induced and regulated in the periphery during T‐cell responses. Using Foxp3‐Timer of cell kinetics and activity (Tocky) mice, which report real‐time Foxp3 expression, we show that the flux of new Foxp3 expressors and the rate of Foxp3 transcription are increased during inflammation. These persistent dynamics of Foxp3 transcription determine the effector Treg programme and are dependent on a Foxp3 autoregulatory transcriptional circuit. Persistent Foxp3 transcriptional activity controls the expression of coinhibitory molecules, including CTLA‐4 and effector Treg signature genes. Using RNA‐seq, we identify two groups of surface proteins based on their relationship to the temporal dynamics of Foxp3 transcription, and we show proof of principle for the manipulation of Foxp3 dynamics by immunotherapy: new Foxp3 flux is promoted by anti‐TNFRII antibody, and high‐frequency Foxp3 expressors are targeted by anti‐OX40 antibody. Collectively, our study dissects time‐dependent mechanisms behind Foxp3‐driven T‐cell regulation and establishes the Foxp3‐Tocky system as a tool to investigate the mechanisms behind T‐cell immunotherapies.
2016
-
Controversies concerning thymus‐derived regulatory T cells: fundamental issues and a new perspective
Masahiro Ono, and Reiko J Tanaka
Immunology and cell biology, Sep 2016
A landmark opinion piece challenging the reproducibility of a foundational Treg experiment, while introducing a groundbreaking dynamic view on Foxp3-mediated T cell regulation.
Thymus-derived regulatory T cells (Tregs) are considered to be a distinct T-cell lineage that is genetically programmed and specialised for immunosuppression. This perspective is based on the key evidence that CD25+ Tregs emigrate to neonatal spleen a few days later than other T cells and that thymectomy of 3-day-old mice depletes Tregs only, causing autoimmune diseases. Although widely believed, the evidence has never been reproduced as originally reported, and some studies indicate that Tregs exist in neonates. Thus we examine the consequences of the controversial evidence, revisit the fundamental issues of Tregs and thereby reveal the overlooked relationship of T-cell activation and Foxp3-mediated control of the T-cell system. Here we provide a new model of Tregs and Foxp3, a feedback control perspective, which views Tregs as a component of the system that controls T-cell activation, rather than as a distinct genetically programmed lineage. This perspective provides new insights into the roles of self-reactivity, T cell–antigen-presenting cell interaction and T-cell activation in Foxp3-mediated immune regulation.